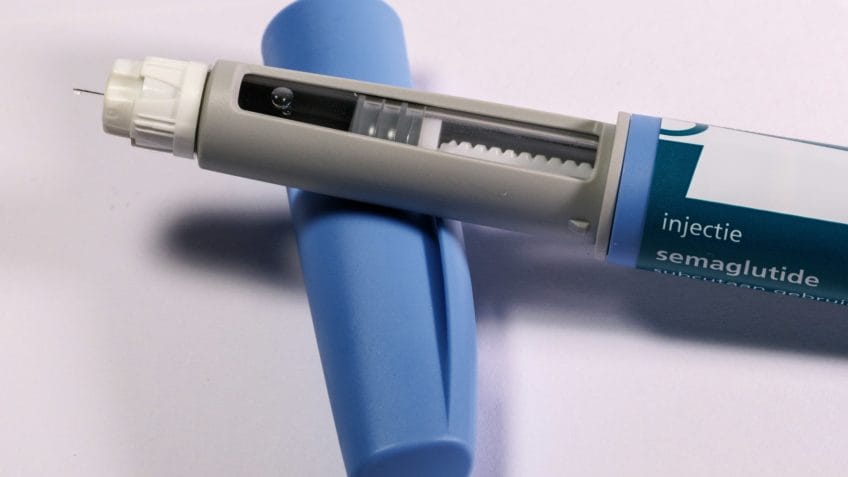
A Anvisa (Agência Nacional de Vigilância Sanitária) decidiu acelerar a análise sobre o registro de 20 canetas emagrecedoras que contêm liraglutida e semaglutida, os mesmos princípios ativos de medicamentos como o Ozempic. A decisão, segundo jornal Folha de S.Paulo, foi tomada depois de solicitação do Ministério da Saúde com o objetivo de antecipar a entrada de novos produtos no mercado brasileiro.
A agência reguladora definiu um cronograma para avaliar os pedidos de registro de canetas emagrecedoras à base de análogos de GLP-1, hormônio produzido no intestino e ligado ao controle da glicose e da saciedade. A Anvisa deve se manifestar ainda em 2025 sobre as solicitações de EMS, Megalabs e Momenta. Em 2026, analisará outras 14 canetas e, em 2027, mais 3.
De acordo com a Folha, o Ministério da Saúde formalizou o pedido com a intenção de estimular a fabricação nacional desses medicamentos. A justificativa seria “reduzir a dependência tecnológica do país, fortalecendo a soberania e autonomia nacional”.
Além da EMS, Megalabs e Momenta, a medida beneficiará outras empresas farmacêuticas como Biomm, Cristália, Libbs, Aspen, Aché, Althaia, Farma Vision, Ranbaxy, Cosmed, Brainfarma, Dr. Reddy’s, Sun e Cipla. Algumas dessas companhias têm mais de um pedido em análise na Anvisa.
A patente da semaglutida expirará em março de 2026, enquanto a da tirzepatida (o Mounjaro, da Lilly) só vence em 2036. A Novo Nordisk, fabricante do Ozempic, tenta estender a validade da patente da semaglutida.
Uma iniciativa para ampliar o acesso a esses medicamentos é a parceria entre a EMS e a Fiocruz (Fundação Oswaldo Cruz) para transferência de tecnologia de produção das canetas à fundação.
Inicialmente, a produção dos medicamentos será realizada na fábrica da EMS em Hortolândia (SP) até que toda a tecnologia de produção seja transferida para o Complexo Tecnológico de Medicamentos de Farmanguinhos, no Rio de Janeiro.
Em agosto, a Anvisa publicou um edital permitindo que empresas solicitassem prioridade na avaliação desses medicamentos, estabelecendo preferência para aqueles com componentes fabricados no Brasil.
O governo também avalia a possibilidade de oferecer o tratamento pelo SUS (Sistema Único de Saúde), embora análises iniciais tenham impedido essa incorporação por causa dos custos elevados dos medicamentos.